Коррозия алюминия и его сплавов (док)
Низкая плотность и механическая прочность в сочетании с удовлетворительной стойкостью к коррозии делают алюминий привлекательным конструкционным материалом, который широко используется в строительстве. Однако с химической точки зрения алюминий — один из наиболее реакционноспособных металлов, который активно взаимодействует не только с кислотами и щелочами, но и с водой! Кажущееся противоречие очень просто объясняется: под воздействием кислорода (или других окислителей) поверхность металлического алюминия покрывается прочной, химически устойчивой оксидной пленкой, предохраняющей металл от разрушения. Это явление называется пассивацией. Металл пассивен в том случае, когда при взаимодействии с потенциальным источником коррозии он не подвергается изменениям, и активен тогда, когда агрессивное вещество его разрушает.
Напомним, что коррозией называется процесс разрушения металлов и их сплавов в результате химического или электрохимического воздействия окружающей среды.
Металл, стойкий к коррозии в одних условиях, может разрушаться в других. Так, например, алюминий стоек к коррозии, вызываемой жидким топливом, и не стоек к действию натриевой щелочи (так называемое явление пассивности и активности).
Окись алюминия создает химически инертный защитный слой, толщина которого составляет 20—100Å. Алюминий, поверхность которого очищена от защитной пленки, может реагировать с водой, выделяя при этом водород. Под влиянием окислителей поверхность алюминия пассивируется, поэтому кислород, содержащийся в воздухе или растворенный в воде, повышает его коррозионную стойкость.
Коррозионная стойкость алюминия в значительной степени зависит от содержания примесей других металлов. Как известно, при контакте двух металлов, погруженных в среду электролита, образуется гальваническая пара, где более активный металл становится анодом, а менее активный — катодом. В результате электрохимической реакции анод разрушается. Большинство примесей (за исключением металлов, более активных, чем алюминий) играют роль катода по отношению к алюминию, т.е. способствуют его разрушению.
По этой причине алюминий высокой чистоты отличается более высокой коррозионной стойкостью, чем технический металл, который, в свою очередь, более устойчив к коррозии, чем сплавы алюминия. Кроме того, коррозионная стойкость алюминия зависит от характеристик окружающей среды и от реакций, вызываемых этой средой в алюминии.
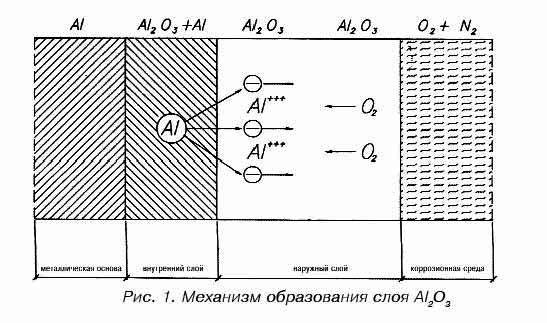
Механизм коррозии алюминия
В присутствии окислителей поверхность алюминия покрывается защитным слоем окиси алюминия.
Защитный слой, в свою очередь, состоит из двух слоев:
-
Внутреннего слоя Al2O3, который образуется при непосредственной реакции кислорода с металлом. Внутренний слой оксида прочно прилегает к металлу основы, а его структура и толщина зависят от температуры окисления.
-
Наружного, образующегося в результате реакции внутреннего слоя с внешней средой, в основном, с водой. Толщина этого слоя зависит от времени протекания коррозии и концентрации агрессивных веществ в окружающей среде. Увеличение толщины наружного слоя происходит за счет окисления металла основы. Наружный слой порист, он пропускает воздух и влагу.
-
В результате коррозионных процессов на поверхности алюминия общая толщина защитного слоя увеличивается, но толщина внутреннего слоя при этом остается постоянной. Схема механизма образования защитного слоя представлена на рис. 1.
Виды коррозии
Коррозию металлов можно разделить на химическую и электрохимическую.
Электрохимическая коррозия происходит при действии на металл растворов электролитов (т.е. растворов, содержащих носители электрического тока — ионы) и сопровождается возникновением электрического тока.
Химическая коррозия происходит при воздействии на металл сухих газов, пыли, жидких веществ (не электролитов) и не сопровождается возникновением электрического тока.
Разрушающее действие коррозии всегда начинается с поверхности металла. Затем коррозия распространяется в глубину со скоростью, зависящей от вида металла или сплава, его состава, структуры, характеристик, а также состава и характеристик окружающей среды. Этому процессу чаще всего сопутствуют изменения внешнего вида поверхности: она становится матовой, изменяет цвет, появляются точки, пятна, вздутия и т. д.
В результате взаимодействия алюминия с окружающей средой образуются вещества (продукты коррозии), свойства которых в значительной мере влияют на протекание коррозионных процессов. Рассмотрим возможные разновидности такого влияния:
-
В процессе коррозии образуются летучие или растворимые вещества, которые легко и быстро удаляются с места реакции и не препятствуют распространению коррозии. В результате реакция проходит по всей поверхности металла, доступной для коррозионного воздействия, и без помех распространяется в глубину.
-
На поверхности металла возникают тонкие, прозрачные, прочно связанные с металлом слои, которые перекрывают доступ агрессивного реагента к металлу основы. Эти слои являются причиной так называемой "пассивации" поверхности. С образованием такого слоя коррозия практически полностью останавливается, а остаточные процессы происходят только на наружной поверхности слоя, который может частично растворяться в агрессивной среде.
-
Неоднородность поверхностного слоя приводит к проявлению неравномерной или местной коррозии. Слой продуктов коррозии неравномерно распределяется по всей поверхности корродирующего металла.
В зависимости от свойств продуктов коррозии можно выделить следующие разновидности последней:
-
Локальная коррозия в виде пятен на поверхности металла.
-
Локальная коррозия в виде разъеданий, которая возникает в случае, если процесс происходит на поверхности малой площади и интенсивно распространяется вглубь металла.
-
Межкристаллическая коррозия, возникающая в случае, если агрессивное вещество поступает вглубь металла и разрушает внешние границы кристаллов (зерен), из которых состоит сплав. Продукты коррозии остаются внутри металла, причем на наружной поверхности не происходит никаких заметных изменений. Это особенно опасный вид коррозии с точки зрения скорости процесса. В этом случае материал, создающий границу зерен, выполняет роль анода по отношению к зернам, которые занимают значительную площадь и действуют, как катод.
-
Коррозия напряжения и ее разновидность — коррозия усталости, возникающая в случае, если, помимо воздействия коррозионной среды, изделие из металла подвергается постоянным или переменным нагрузкам.
-
Селективная (избирательная) коррозия, во время которой одна или несколько составных частей сплава подвергается коррозии, а пористая основа сплава сохраняет первоначальную форму изделия.
Электрохимическая коррозия
В техническом алюминии (или в его сплавах) содержатся примеси металлов в виде отдельных вкраплений (магний, титан, железо, марганец и др.)
Благодаря наличию таких вкраплений сплав, погруженный в электролит, представляет собой совокупность большого количества микроскопических гальванических очагов. В результате электрохимической реакции, возникающей в этих очагах, металл, выступающий в роли анода (а в нашем случае это основной компонент сплава, алюминий), растворяется, в то время как на микрокатодах выделяется водород (рис. 2).

Такие микроисточники коррозии по своей природе являются обычными гальваническими элементами и отличаются:
-
1 микроскопическими размерами анода и катода;
-
2 горизонтальным расположением электродов;
-
3 прямым соединением катода и анода.
Процесс электрохимической коррозии не всегда является результатом возникновения микроскопических гальванических элементов. В ряде случаев очаги коррозии имеют "видимые" (макроскопические) размеры.
Механизм электромеханического коррозионного разрушения для разной величины поверхности катода (сталь) и анода (алюминий) представлен на рис. 3.
Атмосферная коррозия
Атмосферной коррозией называют процесс разрушения металлов на воздухе в результате происходящих на их поверхности химических и электрохимических реакций. Это наиболее распространенный пример разрушения металлов.
Основной причиной атмосферной коррозии является тонкий слой влаги, который образуется на поверхности металла, если его температура находится ниже точки росы. С понижением температуры или при увеличении содержания водяного пара в воздухе излишек пара оседает в виде капель воды.
Если поверхность негладкая, покрыта пылью и слоями продуктов коррозии, то значительно раньше достижения точки росы во всех углублениях, порах и трещинах конденсируется пар и образуется слой воды.
Некоторые газообразные вещества, содержащиеся в атмосфере, такие как оксиды азота, серы, хлорид водорода и другие, растворяются в конденсированной влаге, образуя кислоты. Поскольку растворимость этих веществ в воде очень высока, они концентрируются в слое воды даже тогда, когда их содержание в воздухе сравнительно невелико.
Скорость коррозии зависит как от характеристик коррозионной среды (внешних факторов), так и от характера самого металла (внутренних факторов).
К внешним факторам относятся:
-
состав среды;
-
температура;
-
давление;
-
ветровые нагрузки;
-
блуждающие токи.
К внутренним факторам относятся:
-
химический состав сплава;
-
структура металла;
-
внутренние напряжения.
Влияние атмосферы на процесс коррозии зависит от климатической зоны, уровня развития промышленности в регионе и загрязненности атмосферы. Наиболее существенными факторами, определяющими коррозионные свойства атмосферы, являются содержание пыли, газов, влажность и температура.
Влиянием этих факторов объясняется различная скорость процесса коррозии в различных точках земного шара. Например, чем ближе к морю, тем больше в воздухе морских солей, ускоряющих коррозию, особенно NaCl. В регионах, где много промышленных объектов, в воздухе много таких соединений, как SO2.
Отметим, что скорость коррозии на воздухе, как правило, значительно ниже, чем в пресной воде или почве. Атмосферную коррозию можно разделить на сухую, влажную и морскую.
Сухая (газовая) атмосферная коррозия проходит в условиях полного отсутствия влаги на поверхности металла. Этот вид коррозии протекает очень медленно. Если в атмосфере содержатся агрессивные газы, то скорость коррозии значительно ускоряется.
Влажная атмосферная коррозия протекает в слое электролита малой толщины. Скорость процесса зависит от влажности воздуха, атмосферных загрязнений и гигроскопичности продуктов коррозии: если эти вещества задерживают влагу на поверхности металла, скорость коррозии возрастает.
Морская атмосферная коррозия. В регионах с морским климатом в состав атмосферы входит большое количество солей, на поверхности металла собираются капли морской воды, соли и другие загрязнения, ускоряющие коррозию.
Взаимодействие алюминия и его сплавов с другими металлами и сплавами
В среде электролита два различных металла, соприкасающиеся между собой или соединенные проводником, образуют гальванический элемент, в котором генерируется электрический ток. Направление движения электронов в гальваническом элементе определяется величинами электродных потенциалов металлов, значения которых приведены в таблице 1. Электроны движутся от металла с более высоким потенциалом (анода) к металлу с низшим потенциалом (катоду). В такой ситуации металл с высоким потенциалом (и большей химической активностью) разрушается.
Таблица 1.
|
Снижение |
Реакция на |
Стандартный |
Элемент |
|---|---|---|---|
|
↓ |
Ca=Ca2++2e- | +2.87 | Кальций |
| Mg=Mg2++2e- | +2.37 | Магний | |
| Al=Al3++3e- | +1.66 | Алюминий | |
| Ti=Ti2++2e- | +1.63 | Титан | |
| Mn=Mn2++2e- | +1.18 | Манганин | |
| Zn=Zn2++2e- | +0.76 | Цинк | |
| Cr=Cr3++3e- | +0.74 | Хром | |
| Fe=Fe2++2e- | +0.44 | Железо | |
| Cd=Cd2++2e- | +0.40 | Кадмий | |
| Ni=Ni2++2e- | +0.25 | Никель | |
| Sn=Sn2++2e- | +0.136 | Олово | |
| Pb=Pb2++2e- | +0.126 | Свинец | |
| H2=2H++2e- | 0.000 | Водород | |
| Cu=Cu2++2e- | -0.337 | Медь | |
| Cu=Cu++e- | -0.521 | Медь | |
| 2Hg=Hg22++2e- | -0.789 | Ртуть | |
| Ag=Ag++e- | -0.800 | Серебро | |
| Hg=Hg2++2e- | -0.854 | Ртуть | |
| Au=Au3++3e- | -1.50 | Золото |
В таблице 1 представлены значения стандартных электродных потенциалов (электрохимический ряд напряжений) для элементов, которые входят в состав алюминиевых сплавов или металлических соединений, использующихся в алюминиевых конструкциях.
Интенсивность коррозии, возникающей при соединении двух металлов, зависит от их расположения в ряду напряжений (разности потенциалов), от соотношения площади поверхности и уровня их поляризации.
Чем больше разность потенциалов в гальваническом элементе, тем выше напряжение и тем интенсивнее разрушается анод. Значения потенциалов, приведенные в электрохимическом ряде напряжений, определены для стандартных условий (температура 25°С и единичная активность ионов в растворе электролита). Нужно учитывать, что в зависимости от состава электролита эти значения могут меняться. Так, например, в щелочных растворах алюминий корродирует значительно сильнее, чем в кислых.
Цинк, потенциал которого близок к потенциалу алюминия, может использоваться для непосредственного контакта с алюминием. Если такой контакт происходит в нейтральных и кислых средах, цинк выполняет функцию анода и поэтому защищает катодный алюминий от коррозии. Однако в щелочных средах, наоборот, активность алюминия возрастает, поэтому цинк ускоряет коррозию алюминия.
При контакте стальных оцинкованных деталей (шурупов и т.д.) с алюминием слой цинка вначале обеспечивает защиту алюминия, но после стирания цинка стальная поверхность становится открытой, что может привести к коррозии алюминия. В контакте с алюминием рекомендуется применение стали, оцинкованной горячим методом, поскольку в этом случае толщина покрытия больше, чем при электролитической оцинковке.
Ни в коем случае алюминий не должен соединяться с медью и ее сплавами, поскольку это приводит к быстрой коррозии алюминия (так называемой "катастрофической коррозии"). В связи с этим в алюминиевых конструкциях недопустимы всякого рода элементы и дополнения из меди.
По этой же причине не следует допускать влияния на алюминий дождевой воды, которая стекает с медных крыш и труб непосредственно на алюминиевые конструкции, даже тогда, когда она содержит небольшие количества ионов меди.
Следует также избегать контакта с оловом и его соединениями, особенно в атмосфере, загрязненной промышленными отходами. Соли олова, образующиеся в кислой среде, сильно разрушают поверхность алюминия.
Свинцовый сурик, при наличии влаги, содержащей кислоту, проявляет сильную коррозионную активность. Поэтому при контакте с алюминием следует избегать стальных элементов, покрытых свинцовым суриком.
Ртуть и ее соли уже в присутствии следов влаги вызывают сильную коррозию алюминия. В этом случае процесс коррозии усиливается благодаря образованию амальгамы: амальгамированный алюминий интенсивно взаимодействует с водой в даже отсутствие кислот и щелочей! Поэтому при складировании алюминиевых профилей даже пары ртути (из разбитой лампочки) могут привести к мгновенной коррозии.
Соединение алюминия и стали допустимо в сельской местности, но на приморских и промышленных территориях сталь ускоряет коррозию алюминия. Поэтому при контакте стали и алюминия необходимо избегать их непосредственного контакта, например, путем оцинковки стали, покраски алюминия с одновременным использованием изолирующих прокладок из синтетических материалов.
При соединении железа, никеля и хрома с алюминием возникает значительная разность потенциалов, поэтому их не следует соединять непосредственно друг с другом. Кроме того, соли этих металлов (хлориды, сульфаты и т. д.), которые образуются в результате их коррозии, также способствуют разрушению алюминия.
Химическая коррозия
Процесс химической коррозии протекает при воздействии сухих газов, жидких неэлектролитов и других материалов (в том числе и строительных) на алюминий.
В результате химической коррозии на поверхности алюминия образуется защитный слой, состоящий из продуктов коррозии и препятствующий взаимодействию агрессивных веществ с металлом. Скорость и вид химической коррозии определяет процесс диффузии агрессивного вещества через защитный слой.
Как мы упоминали ранее, слой окиси алюминия возникает на поверхности в результате окисления металла кислородом воздуха. На воздухе в отсутствие влаги толщина этого слоя в течение нескольких минут достигает 10 Å.
Химическая стойкость сплавов алюминия
Вода
В дистиллированной воде алюминий проявляет очень хорошие показатели стойкости к коррозии при любой температуре.
Дождевая вода может разрушать алюминий, если в атмосфере содержится значительное количество промышленных газов. Растворяясь в воде, это газы (SO2, NO2, хлороводород и т.д.) образуют кислоты, разрушающие алюминий. Поэтому во избежание коррозии алюминиевые конструкции следует проектировать так, чтобы свести до минимума скапливание дождевой воды на поверхности металла.
Водопроводная вода действует на алюминий по-разному, в зависимости от содержащихся в ней примесей. В кислых или щелочных водах алюминий может подвергаться коррозии. Процесс коррозии ускоряют ионы хлора или тяжелых металлов, содержащиеся в водопроводной воде.
Промышленные сточные воды вызывают очень сильную коррозию, которую ускоряют ионы тяжелых металлов.
Газы
Водород, азот и благородные газы (гелий, аргон, неон, криптон, ксенон) не действуют на алюминий даже при повышенных температурах.
Галогены (хлор, бром, йод, фтор) в отсутствие влаги не действуют на алюминий. При взаимодействии с водой они образуют кислоты, агрессивные по отношению к алюминию.
Сухие хлороводород, бромоводород, йодоводород, фтороводород не действуют на алюминий. Но водные растворы этих газов — кислоты, активно разрушающие алюминий.
Сероводород не разрушает алюминий при температуре до 500°С.
Двуокись серы в отсутствие водяного пара не разрушает алюминий (до 400°С), хотя при наличии влаги вызывает коррозию. Аналогично действует и триокись серы.
Аммиак в газообразном состоянии не действует на алюминий даже при высоких температурах.
Оксид углерода СО разрушает алюминий только при температуре свыше 550°С.
Углекислый газ ведет себя аналогично СО. В воде углекислый газ образует угольную кислоту, не вызывающую значительных коррозионных разрушений.
Неорганические соединения
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.
Органические соединения
Не вызывают коррозии:
-
Все насыщенные углеводороды, бензол, толуол, нафталин.
-
Алифатические спирты (взаимодействие с алюминием возможно только после испарения воды и только при нагревании). Метиловый спирт вызывает незначительную коррозию в водном растворе, самую сильную — при 25% содержании воды. Другие спирты, такие как этиловый, пропиловый, глицерин и его производные, не приводят к коррозии алюминия.
-
Фенол и его водные растворы (незначительное разрушение происходит при температуре свыше 60°С и концентрации 50%). Аналогично ведут себя производные фенола.
-
Сложные эфиры.
-
Альдегиды, в том числе формалин, акролеин, бензальдегид.
-
Кетоны.
-
Фреоны.
-
Амины и амиды.
-
Некоторые галогенсодержащие соединения (например, поливинилхлорид).
-
Углеводы: глюкоза, лактоза, целлюлоза.
Приводят к незначительной коррозии:
-
Некоторые органические соединения хлора, выделяющие соляную кислоту вследствие гидролиза в водных растворах.
-
Водные растворы органических кислот: уксусной, муравьиной, монохлоруксусной, щавелевой, винной, лимонной, яблочной, салициловой, аскорбиновой и т. д.
Сильно действуют на алюминий:
-
Некоторые органические кислоты при полном отсутствии воды.
-
Соли органических кислот могут создавать источники локальной коррозии.
-
Четыреххлористый углерод вызывает сильную коррозию в присутствии следов влаги.
-
Большинство соединений галогенов разрушают алюминий, скорость коррозии увеличивается с ростом температуры. Коррозионная активность галогена уменьшается в следующей последовательности: F-Cl-Br-I.
-
Некоторые серосодержащие органические соединения, например этилсерная кислота.
Материалы естественного происхождения
Не действуют на алюминий:
-
Каменная соль.
-
Продукты нефтеперегонки: бензин, керосин, парафин, масла, смолы.
-
Воск.
-
Каучук.
-
Эфирные масла.
-
Каменный уголь, антрацит, бурый уголь.
-
Целлюлоза.
-
Белки.
-
Природный гипс.
-
Особо чистые виды нефти.
Действуют на алюминий:
-
Нефть, а точнее — содержащиеся в ней загрязнения, в основном, вода с растворенными в ней солями, которые в результате гидролиза образуют кислоты.
-
Дубильные вещества.
-
Средства для импрегнации древесины.
-
Глина.
Продукция синтетической химии и промышленные продукты
Не действуют на алюминий:
-
Синтетические смолы.
-
Инсектецидные средства (за исключением арсената натрия).
-
Косметические препараты.
-
Лаки.
-
Органические красители.
-
Некоторые клеи, не содержащие солей тяжелых металлов.
Действуют на алюминий умеренно или сильно:
-
Чистящие средства.
-
Моющие средства.
-
Некоторые косметические препараты (кислые или щелочные).
-
Одеколон.
-
Неорганические красители.
-
Чернила и тушь.
-
Клеи.
-
Продукты сгорания органических веществ, в особенности серо- и азотсодержащих.
Строительные материалы
На практике монтажные работы очень часто реализуются параллельно со строительными, так называемыми "мокрыми" работами.
Строительные материалы, такие, как штукатурки, портланд-цемент, бетон, мел, очень сильно влияют на алюминий, поскольку при контакте с водой дают щелочную реакцию. Под воздействием этих материалов в присутствии влаги на контактных поверхностях необработанного, анодированного, и даже алюминия с порошковым покрытием появляются пятна.
Коррозия длится до затвердевания штукатурки, цемента или бетона. В случаях, когда бетонная конструкция периодически подвергается увлажнению, ее следует изолировать от алюминия битумной прокладкой. Рекомендуется изолировать алюминий от наружных железобетонных конструкций. В сухих помещениях, когда бетон "схватился", поверхность алюминия можно не изолировать.
Особенно вредно для алюминия действие бетонов, содержащих хлорид магния, позволяющий производить бетонирование во время морозов. А цементы с высоким содержанием алюминия, менее щелочные, чем обычные цементы, разрушают конструкционный алюминий значительно слабее.
Наталия Донская, журнал "Витрина" № 1(15)'2002
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии
-